 |
| About Bioline | All Journals | Testimonials | Membership | News |
|
||||||
|
||||||
Entomotropica , Vol. 19, No. 3, Diciembre, 2004, pp. 113-134 Dinámica de transmisión y modelos matemáticos en enfermedades transmitidas por vectores María-Gloria Basáñez1 y Diego J. Rodríguez2 1 Departamento de Epidemiología de Enfermedades Infecciosas.
Facultad de Medicina, Imperial College of Science, Technology and Medicine
(St. Mary's campus)Norfolk Place, Londres W2 1PG, Reino Unido. Investigadora
asociada del Centro Amazónico para Investigación y Control de
Enfermedades Tropicales 'Simón Bolívar’ (CAICET),
Puerto
Ayacucho, Estado Amazonas, Venezuela. E-mail: m.basanez@imperial.ac.uk Code Number: em04020 Resumen BASAÑEZ M-G, RODRÍGUEZ DJ. 2004. Dinámica de transmisión y modelos matemáticos en enfermedades transmitidas por vectores. Entomotropica 19(3): 113-134. La moderna teoría de la dinámica de enfermedades infecciosas está influenciada por la teoría ecológica, especialmente por la demografía.El estudio de esta dinámica, por medio de modelos matemáticos, ha tenido un amplio desarrollo en los últimos años, y ha demostrado ser una valiosa herramienta para entender patrones y procesos epidemiológicos, siempre y cuando los modelos sean lo suficientemente reales y basados en conocimiento biológico. Se discuten los conceptos básicos de la dinámica de transmisión de agentes infecciosos que afectan a un hospedero y un insecto vector. Se estudian específicamente modelos matemáticos de dinámica de la malaria humana en ambientes espacialmente homogéneos, y en ambientes espacialmente fragmentados. También se presentan modelos de la dinámica de transmisión de la oncocercosis humana. Se discuten los resultados y su utilidad básica y aplicada. Palabras clave adicionales: control, dinámica poblacional, epidemiología, malaria, modelos matemáticos, oncocercosis, vectores dípteros. Abstract BASAÑEZ M-G, RODRÍGUEZ DJ. 2004. Transmision dynamics and mathemathical models in vector transmited diseases. Entomotropica 19(3):113-134. Modern theory on the dynamics of infectious diseases is influenced by ecological theory,especially by demography.The study of these dynamics using mathematical models has had a staggering development in recent years,and has proven to be a valuable tool to understand epidemiological patterns and processes, provided that models are as close as possible to real life situations and based on biological knowledge. We discuss the basic concepts of the transmission dynamics of infectious agents affecting a host and an insect vector. We specifically study mathematical models for the dynamics of human malaria in both spatially homogeneous and fragmented environments. Models for the dynamics of human onchocerciasis are also presented. Finally we discuss the results and their basic and applied importance. Additional key words: control, dipteran vectors, epidemiology, malaria, mathematical models, onchocerciasis, population dynamics. Introducción En este artículo se introducen algunos conceptos de al riesgo de infección y enfermedad al que están sometidodinámica poblacional pertinentes a la investigación otros habitantes de la misma población. El estudio de epidemiológica de las enfermedades transmisibles. La epidemiología puede definirse como la disciplina que estos procesos se conoce como dinámica de transmisión.estudia el proceso salud-enfermedad desde el punto de vista Ya que los agentes patógenos que circulan entre un grupo de hospederos conforman en sí mismos una población de poblaciones y comunidades. A su vez, una población no es de extrañar que la epidemiología de enfermedades es un conjunto de organismos de una misma especie que infecciosas se haya nutrido de los conceptos e instrumentos ocupan un área determinada. La unidad básica de dicha población es el individuo. Una diferencia fundamental desarrollados por la biología de poblaciones. Es por tanto entre la epidemiología de enfermedades parasitarias y no una disciplina fuertemente cuantitativa, que requiere de métodos estadísticos y matemáticos para unificar y trascender descripciones empíricas de los patrones y procesos bajo estudio. Como disciplina demográfica, la epidemiología ecológicatrata de los eventos de inmigración, reproducción,natalidad, crecimiento, emigración, mortalidad y extinción que se suceden en las poblaciones de hospedadores,parásitos, reservorios, y posibles vectores que conformanel paisaje epidemiológico de una determinada infecciónen el tiempo y en el espacio. Por otro lado, es esencialcomprender a fondo la historia natural y el ciclo de vidadel agente infeccioso de interés, es decir, la biología de losorganismos en cuestión. Los modelos matemáticos quecarezcan de una profunda comprensión de estos aspectosde la biología no dejarán de ser divertimentos intelectuales con escasa aplicación práctica. En raras ocasiones los agentes patógenos se presentan en forma aislada; unamisma población de hospederos puede padecer malariahepatitis, oncocercosis y parasitosis intestinales entre otras.Por esta razón un enfoque de ecología comunitaria en elestudio e interpretación de infecciones poliparasitariaspodría constituir un terreno fértil aún poco explorado. Sinembargo, por los momentos, y a fin de lograr cierto gradode simplicidad y generalidad en el estudio epidemiológicode enfermedades transmisibles, que por lo demás poseencomplejos ciclos de vida, nos restringiremos a un enfoquepoblacional. A fin de obtener una descripción operacional de los cambios temporales y espaciales en la abundancia poblacional dehospedadores y parásitos, es necesario comenzar por unmodelo que refleje nuestro conocimiento del sistema bajoestudio (este proceso no es en modo alguno diferente deaquel por medio del cual constantemente observamos e interpretamos el mundo en el que estamos inmersos).Al comienzo, este modelo puede ser una representación conceptual y verbal de los elementos que lo conformany de la comunicación que se supone existe entre taleselementos, es decir, una abstracción mental de la realidad. El fin último puede ser la construcción de un modelomatemático que traduzca en variables, tasas, y ecuacionestales elementos y transiciones con el objetivo de lograruna mayor comprensión de los procesos que regulan laspoblaciones de agentes patógenos, y que por tanto sirvade herramienta para implementar y monitorear programasde control. Es interesante recordar que entre las primeras aplicacionesde las matemáticas en el modelaje de sistemas biológicosse encuentran los estudios de epidemiología matemática (Ross 1911; Kermack y McKendrick 1927), y que hoy endía esta rama es una de las más florecientes disciplinas delas matemáticas aplicadas gracias a los trabajos de diversosautores (Bartlett 1956; Kendall 1956; Macdonald 1957Bailey 1975; Anderson y May 1991). En lo que sigue recorremos el camino de la elaboraciónde modelos epidemiológicos, comenzando por representaciones sumamente esquemáticas del ciclo devida de dos especies de parásitos de gran importancia enVenezuela. Concluimos elaborando modelos matemáticos sencillos que permiten explorar algunas preguntas en lo concerniente a su dinámica poblacional y control. Estas infecciones son la malaria (causada por Plasmodium spp,un ejemplo de microparásitos), y la oncocercosis (debida a Onchocerca volvulus,un macroparásito).El lector interesado en modelos de otras enfermedades transmitidas porinsectos vectores puede consultar trabajos generales comoel de Rogers (1988), o estudios más específicos como loshechos en dengue (Esteva yVargas 1998,1999,2000),y enenfermedad de Chagas (Velasco-Hernández 1994). Una división funcional que proporciona un marco de referencia para el estudio de la dinámica de transmisiónde enfermedades parasitarias es la de considerar que launidad de estudio poblacional es el hospedador (éstepuede identificarse como susceptible, infectado, inmune,etc.), o el parásito (el cual puede clasificarse de acuerdo asu estadio dentro del ciclo vital como microfilaria, larva,adulto, etc.). Por lo general, el primer caso se aplica si seintenta describir la epidemiología de microparásitos, y elsegundo si se trata de macroparásitos. Microparásitos. Aquí se incluyen los virus, bacterias yprotozoarios, de pequeño tamaño y con la posibilidad demultiplicarse directa y rápidamente dentro del hospedador.Esto, sumado a la capacidad del hospedador para montaruna respuesta inmunológica más o menos eficaz, dificultael recuento del número preciso de parásitos por individuoinfectado, haciéndose casi imposible el obtener una descripción exacta de la abundancia poblacional del agenteinfeccioso en un momento dado. En cambio, es por logeneral factible detectar los casos de infección (presente o pasada) en la población de hospedadores, convirtiéndoseéstos en las unidades naturales de estudio. Se hace así conveniente discriminar entre individuos susceptibles(no infectados aún); latentes; infectados (e infectantes), yrecuperados (pueden o no haber adquirido inmunidad depor vida). Esto conduce a que los índices epidemiológicos de prevalencia a (la proporción de infectados en un punto del tiempo) e incidencia a (el número de casos nuevos durantecierto período) sean de particular interés en el estudiode microparásitos. Si la incidencia se mide per capita a de individuo susceptible constituye la fuerza de infección. Los modelosquesedesarrollansonmodeloscompartamentalesde prevalencia (las variables de interés pueden ser la fracción de hospederos y de vectores infectados, comoen el caso del paludismo). Ejemplos de organismos quenaturalmente entran en esta categoría incluyen los agentescausales de las enfermedades de la infancia preveniblespor vacunación (sarampión, polio, rubéola, entre otras), de las hepatitis virales, dengue, enfermedades de transmisiónsexual incluyendo el virus de inmunodeficiencia humano, y los protozoarios causantes de la leishmaniasis,tripanosomiasis, y malaria entre otros. Macroparásitos. Comprenden los helmintos y los ectoparásitos (artrópodos), de mayor tamaño y en general sin la capacidad de multiplicarse directamentedentro o sobre el hospedador (obviamente existen algunas excepciones). Ya que a fin de alcanzar la madurezreproductiva y completar su ciclo de vida deben infectarnuevos hospederos, los macroparásitos producen estadiosde transmisión adaptados para ganar acceso al ambiente.Es por tanto posible, al menos en principio, cuantificarmediante métodos indirectos (o en algunos casos directos)el número de parásitos albergados por un hospedador, y enconsecuencia el parásito en sí mismo constituye la unidadde estudio. La respuesta inmunológica protectora anteestos agentes se desarrolla más lentamente, la reinfección es frecuente, pueden alcanzarse elevadas prevalencias, y las infecciones se hacen crónicas y endémicas. La carga parasitaria es de fundamental importancia ya queusualmente está asociada con la patología causada porla infección. La mayoría de los modelos matemáticos que se desarrollan para macroparásitos son modelos de intensidad (las variables de interés corresponden alnúmero de parásitos de cierto estadio en el hospedador definitivo, intermediario o vector). En esta categoría seincluyen los parásitos tremátodos (Schistosoma, Fasciola), céstodos (Taenia, Echinococcus ) nemátodos (Ascaris,Trichuris, Necator, Onchocerca), y los ectoparásitos. Esta clasificación no es una división taxonómica ni rígida,sino una categorización que resume algunos aspectosimportantes de la transmisión, persistencia, estabilidad, ypatología de los agentes causales. Como ejemplo de estaflexibilidad, está el caso de la bilharzia (esquistosomiasis),para la cual se emplean modelos de intensidad con elobjetivo de describir la dinámica de infección en los humanos y otros vertebrados, y modelos de prevalencia para la correspondiente en los caracoles, que actúan como hospederos intermediarios en los que sí ocurre multiplicación directa del parásito (Anderson y Ma1985). Asimismo se han empleado modelos de prevalenciapara estimar la fuerza de infección en filariasis linfática yoncocercosis (véase la revisión de modelos en oncocercosis presentada por Basáñez y Ricárdez-Esquinca 2001). El Cuadro 1 presenta las principales características de ambos grupos. Modelos de prevalencia. Malaria: El modelo de Ross-Macdonald La malaria o paludismo es la infección causada por parásitos protozoarios del género Plasmodium (Apicomplexa: Plasmodiidae) y transmitida entre los humanos por mosquitos hembra del género Anopheles (Diptera: Culicidae). El ciclo de vida comprende por tanto plasmodios, humanos y vectores (transmisión indirecta).Ya que el objetivo que nos ocupa es la elaboración deun modelo de transmisión entre humanos y vectores, yno de morbilidad o de dinámica dentro del hospedador, nos concentraremos en aquellos hospedadores (humanosy mosquitos) que albergan los estadios de transmisión, esdecir, los humanos infectados (e infectantes) que portangametocitos en circulación periférica, y los mosquitos infectados (e infectantes) que tienen esporozoítos en glándulas salivares. Los gametocitos son los estadios capaces de infectar mosquitos, mientras los esporozoítosson las formas infectantes para los humanos. Dividiremosla población de humanos y de vectores cada una en doscompartimientos: susceptibles e infectados. La suposicióninicial es que la inmunidad en malaria se desarrolla lentamente, y que los humanos infectados se recuperany vuelven a ser susceptibles. Los mosquitos infectadosno se recuperan y permanecen infectantes de por vida.El ciclo de vida del Plasmodium ocupa tan sólo una pequeña fracción de tiempo (semanas) en relación conla expectativa de vida del humano (años), y por tanto la tasa per capita a de recuperación (a la cual llamaremos g) es mucho mayor que la tasa per capita a de mortalidad del humano (a la cual designaremos como µ). En contraste, el desarrollo y multiplicación del parásito dentro del Anopheles constituye una porción importante de la expectativa de vida del mosquito, y en consecuencia la tasa per capita a de mortalidad del vector v) no puede ignorarse.El Cuadro 2 resume las suposiciones más importantes delos modelos de Ronald Ross y George Macdonald. Antes de proseguir con la presentación formal del modelo, es necesario mencionar algunas de las características biológicas más importantes en la epidemiología de lasenfermedades transmitidas por vectores artrópodos. Características biológicas de interés en la epidemiología de enfermedades transmitidas por artrópodos con particular referencia a vectores Dípteros Hematofagia, transmisión biológica y densidad de vectores En la transmisión de agentes infecciosos donde intervienen vectores artrópodos, los estadios de transmisión producidos en el hospedador vertebrado alcanzan un nuevo hospedador susceptible mediante la picada de unartrópodo hematófago, es decir, que requiere de la ingesta de sangrepara su propio ciclo vital. Si la transmisión es biológica (lo opuesto a transmisión mecánica), el parásito completará dentro del vector una parte de su desarrollo (período de incubación extrínseca), el cual puede o no estar acompañadode multiplicación. En los ejemplos que nos ocupan, dentrode los anofelinos se produce desarrollo y multiplicaciónde los parásitos maláricos durante el proceso medianteel cual los gametocitos ingeridos junto con la sangre danlugar a los esporozoítos. Dentro de los simúlidos vectoresde la oncocercosis, se produce la transformación de microfilarias ingeridas hasta larvas infectantes (de tercerestadio) sin que haya multiplicación de las mismas. Puedeapreciarse que un modelo de prevalencia (proporción demosquitos infectados) es más conveniente para el estudiode la epidemiología del paludismo, mientras un modelo deintensidad (número de larvas por mosca) es más apropiadopara la oncocercosis. En el caso de los insectos dípteros (incluye a las familias Culicidae y Simuliidae entre otras), sólo la hembra es hematófaga, necesitando unacomida sanguínea para el desarrollo de un lote de huevos (concordancia gonadotrófica). La densidad de vectores por persona, q, en un localidad dada viene expresada por elcociente entre la población total de mosquitos o moscas (M) y la población total de humanos (N) en dicha localidad; es decir q = M/ N. Número fijo de picadas por unidad de tiempo Ya que la ingesta de sangre de vertebrados y el desarrollodeloshuevosdelinsectoestánestrechamenterelacionadosla hembra no realizará una nueva comida sanguínea hastano haber ovipuesto el lote anterior. El período de tiempoentre dos comidas sanguíneas consecutivas se conoce como ciclo gonadotrófico,g . La frecuencia de picada por hembraes por consiguiente el recíproco de la duración del ciclogonadotrófico, 1/ g , o más generalmente el recíproco delintervalo entre dos comidas sanguíneas consecutivas. (En Aedes aegypti, vector del dengue, la frecuencia de picadapuede ser de más de una picada por día, pues si la hembra es interrumpida durante la consecución de la comida sanguínea puede volver a intentar picar inmediatamentesobreotraspersonasenelmismorecinto,locualincrementaen gran medida su capacidad vectorial.) En el caso de lossimúlidos hembra, las cuales pican en promedio cada tresdías, es fácil entender que la frecuencia diaria de picadapor simúlido es 1/3 día-1. Proporción de comidas sanguíneas de origen humano tasa de picadas por persona Es razonable suponer que los vectores obtienen algunascomidas sanguíneas de otros vertebrados. Llamaremos h a la fracción de ingestas sanguíneas realizadas sobrehumanos. Así, h = 0 indica una especie o población completamente zoofílica, mientras h = 1 corresponde aun vector totalmente antropofílico. Por lo general, en lasinfecciones que aquí nos interesan lo más probable esque 0 < h < 1. La frecuencia de picada sobre humanosvendrá dada por el parámetro h / g . Finalmente,la tasa de picadas por persona viene dada por qa . Nótese que q es un simple número, la densidad de vectores por persona enuna localidad; no tiene unidad de tiempo y por tanto no esuna tasa. El índice de comidas sanguíneas originadas sobrehumanos, h, es una proporción y por consiguiente no tieneunidades. La unidad de tiempo, y lo que convierte a en una tasa es que a tiene como denominador g, la duracióndel ciclo gonadotrófico, medida en unidades de tiempo. Susceptibilidad a la infección No todas las especies o poblaciones de vectores son igualmente capaces de permitir la multiplicación y/odesarrollo del parásito hasta la fase infectante. Existendiferencias en cuanto a la susceptibilidad o resistenciaintrínsecas o adquiridas. Llamaremos c a la proporciónde picadas sobre humanos que producen una infecciónexitosa en el vector. De igual manera denominaremos p a la probabilidad que una picada origine una infeccióncompleta en el humano. Expectativa de vida o duración promedio de vida devectores y humanos De la misma manera que el recíproco de la duracióndel ciclo gonadotrófico es igual a la tasa de picada pormosquito; el recíproco de la duración promedio de la vidainfectante del vector es igual a la tasa de mortalidad de losvectores (recordando que el modelo de malaria de Ross-Macdonald ignora el período de incubación extrínseca ysupone que los vectores infectados permanecen infectantes de por vida). Igualmente, la tasa de recuperación de humanos es el recíproco de la duración media del eventomalárico. Versiones posteriores del modelo (Garrett-Jones 1964) incorporan latencia y el llamado factor de longevidad ad (la expectativa de vida infectante considerando la probabilidad de sobrevivencia diaria de los mosquitos y la duración del período de incubación extrínseca). Másadelante veremos el efecto sobre la prevalencia de infecciónque tiene la inclusión de latencia en el vector. El Cuadro 3 presenta una lista de la nomenclatura utilizada para denominar parámetros y variables en el modelo sencillo de Ross-Macdonald. Este modelo será posteriormente modifi cado para permitir movilidad entre poblaciones humanas (es decir las poblaciones dejan de ser cerradas). La Figura 1 esquematiza el diagrama de fl ujo empleado para representar las interacciones entre los compartimientos de las poblaciones humana y vectora que han sido, cada una, divididas en dos categorías: la proporción de humanos o de mosquitos susceptibles ((1-x) y (1- y ), respectivamente), y la proporción de humanos o de mosquitos infectados (x e y). Ecuaciones del Modelo de Ross-Macdonald A fin de expresar los cambios temporales en la prevalencia de la infección malárica en los humanos y anofelinos emplearemosunsistemadeecuacionesdiferencialesordinarias. Dichas ecuaciones representan la tasa de cambio de la variable en cuestión con respecto al tiempo. Este modelo ignora estructura explícita de edades en las poblaciones humana y vectora. Ya que las ecuaciones no incorporan variabilidad estocástica (aleatoria) en los parámetros componentes, cada vez que resolvemos el sistema para un conjunto dado de condiciones iniciales y de valores de los parámetros, obtenemos una misma respuesta; esto quiere decir que el modelo es deterministico. Si bien reconocemos que las suposiciones básicas del modelo son simplificaciones gruesas de la realidad y que el azar juega un papel fundamental en la determinación de los patrones epidemiológicos que detectamos y registramos, un principio esencial del modelaje matemático en enfermedades infecto-contagiosas es el de comenzar por modelos sencillos y transparentes, que permitan comprender el comportamiento cualitativo de las variables introducidas, incorporando niveles crecientes de complejidad a medida que la misma se hace necesaria para reproducir los patrones observados y entender los procesos subyacentes. El sistema de ecuaciones se deriva fácilmente del diagrama de flujo presentado enla Figura 1. Los términos de ganancia o de pérdida correspondientes a cada compartimiento se acompañan, respectivamente, por un signo positivo (+) o negativo (-). Así, la ecuación que representa la tasa de cambio con respecto al tiempo de la fracción de humanos infectados es.
donde los humanos susceptibles (1-x) se infectan con una probabilidad p por picada cuando están expuestos a una tasa de picadas infectantes por persona igual a qay, y los infectados (x) se recuperan con una tasa g por persona.La ecuación para la tasa temporal de cambio en la proporción de anofelinos infectados es, en la cual los vectores susceptibles (1- y ) se infectan con una probabilidad c por picada cuando se alimentan sobre humanos infectados (e infectantes, x) con una tasa de picada por mosquito sobre humanos a, y los vectores infectados mueren con una tasa per capitade mortalidad igual a v. El Número Reproductivo Básico (R0) y la Capacidad Vectorial (C) Una vez que la malaria es introducida en cierta localidad donde existen anofelinos y hospedadores humanos, es importante investigar las condiciones bajo las cuales la infección podría mantenerse en forma endémica (malaria estable), o brotes epidémicos seguirían un patrón que podría ser estacional (malaria inestable); es decir, estamos hablando de las condiciones que promueven la persistencia de una infección una vez que ésta ha invadido cierta localidad. Si cada caso de malaria genera en promedio más de un caso durante el período que dura la infección en el humano, el número reproductivo básico, R0, es mayor que 1 y es obvio que se producirá una epidemia. Con el desarrollo de inmunidad por parte del hospedador (ignorada en el presente modelo), el pool de susceptibles terminaría por agotarse y la infección acabaría por desaparecer. En malaria existe una relación compleja entre la intensidad y patrón temporal de la transmisión a la que está sometida una población hospedadora y el eventual desarrollo de inmunidad especialmente en los adultos. El pool de susceptibles continuaría siendo alimentado por nacimientos (y por inmigraciones de individuos con poca o ninguna exposición previa). En el caso de alcanzarse un equilibrio endémico, cada caso generaría en promedio un caso nuevo (el número reproductivo efectivo sería Re = 1). Es posible expresar, al menos teóricamente, las condiciones bajo las cuales el paludismo se extendería en una población humana y vectora una vez introducida la semilla malárica. Esta expresión, la cual encapsula los principales elementos determinantes de la transmisión de un agente infeccioso en un ambiente dado es el número reproductivo básico (R0). Para microparásitos R0 se defi ne como el número promedio de casos nuevos generados, durante la duración de la infección, por un caso introducido en una población totalmente susceptible (Anderson y May 1991). Es importante enfatizar que el número reproductivo básico se refi ere únicamente a la situación en la cual no existe regulación alguna sobre la población del parásito, es decir, durante los primeros momentos de su introducción en una población inmunológicamente virgen, y que por tanto se trata del potencial reproductivo máximo en una situación específi ca. En malaria, así como en otras infecciones transmitidas por vectores, la capacidad vectorial se defi ne como la tasa diaria de generación de casos nuevos bajo estas mismas condiciones y por tanto C = R0 g . Una aproximación intuitiva a la derivación del número reproductivo básico es la de considerar que debe haber transmisión del humano al vector así como del vector al humano para completar el ciclo vital del parásito. El número de casos de infección en el mosquito, generados durante la duración de la infección en el humano sería ac/g . A su vez, el número de casos de malaria en el humano originados durante la duración de la infección en el anofelino es igual a qap/v . Multiplicando ambos términos para completar el ciclo vital, se obtiene la expresión de R0 en términos principalmente entomológicos,
y por consiguiente, la capacidad vectorial es,
Puede apreciarse que la tasa de picada, a, aparece al cuadrado, pues el anofelino tiene que picar al menos dos veces para infectarse y transmitir la infección. El umbral de introducción y persistencia es R0 = 1; R0 < 1 implica extinción de la infección en la localidad de interés; R0 > 1 establece las condiciones para invasión. También puede observarse que variaciones estacionales de la densidad de anofelinos (es decir, variaciones de q), de la competencia vectorial (c), o de la tasa de mortalidad de los vectores ( v), implicarán variaciones en C y R0. Asimismo, medidas de control orientadas a la reducción del contacto hombrevector (qa) (mosquiteros, repelentes), sobrevivencia del mosquito (LM=1/ v ) (insecticidas), duración de la infección en el humano (DN =1/g) (tratamiento), y reducción del /g establecimiento de la infección en humanos ( p ) y vectores (c) (vacunas), ejercerán un impacto sobre la dinámica de transmisión a través de la reducción de los componentes de la capacidad vectorial y del número reproductivo básico. Ahora podemos resolver las ecuaciones (1) y (2) para obtener la prevalencia de infección en humanos y mosquitos en el equilibrio endémico como funciones de R0 (recordando que en la situación de equilibrio dx/dt = dy/dt = 0 y el asterisco indica equilibrio),
Las expresiones (3)–(6) ignoran los períodos de incubación en humanos y vectores. A fi nes de ilustrar la importancia epidemiológica del período de incubación extrínseca, invitamos al lector a calcular los valores de R0, C, C x* e y* con el siguiente conjunto de parámetros: M = 1000, N = 100, a = 0.33 día -1 (equivalente a suponer que todas las comidas sanguíneas son de origen humano y que el mosquito pica cada tres días), c = 0.05, p = 0.20, LM = 10 días (en consecuencia v = 0.1 día -1), y DN = 50 días ( g = 0.02 día -1). Con estos valores cada caso generaría en promedio 5 casos nuevos (0.1 casos por día) al comienzo del brote malárico, alcanzándose un 80% de prevalencia de infección en los humanos y 12% en los mosquitos. Aquellos lectores que sepan de disección de mosquitos pensarán en estos momentos que el modelo no sirve, que no vale la pena continuar leyendo este artículo, pues está claro que en el campo la proporción de anofelinos infectados no pasa de 1-3%. En 1964 Garrett-Jones introdujo en las ecuaciones anteriores el llamado ‘factor de longevidad’, que incorpora el período de incubación en los mosquitos de tal manera que el nuevo LM se refi ere no a la expectativa de vida del M mosquito como tal, sino a su expectativa de vida infectante. Se hallan en la literatura dos formulaciones del factor de longevidad, según el período de incubación extrínseca se considere una variable de tiempo discreta (7) o contínua (8), 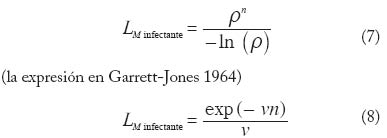
(la expresión en Rogers 1988) En la ecuación (7) r es la probabilidad de sobrevivencia diaria, n es la duración en días del período de incubación del parásito en el mosquito, y – ln ( r) es equivalente a la tasa diaria de mortalidad. Esto se debe a que la consecuencia matemática de suponer que la mortalidad del vector, v, es constante, es que la probabilidad de sobrevivencia, S, está distribuída exponencialmente en el tiempo, S(t) = exp (-vt); de un día para el próximo t = 1 y S (t = 1 día) = r. Tomando logaritmos naturales en ambos miembros de la expresión para S(t), obtenemos v = – ln ( r). Puesto que 1/[– ln ( r)] es la expectativa de vida del mosquito, y rn es la probabilidad de que el mosquito sobreviva los n días necesarios para albergar estadios infectantes, la expresión (7) representa la expectativa de vida residual del vector una vez alcanzado el estadio infectante. El numerador de la expresión (8) es sencillamente la probabilidad, en el modelo exponencial, de haber sobrevivido n días. Ya que el período de multiplicación y desarrollo en el vector constituye una fracción signifi cativa de su expectativa media de vida, muy pocos mosquitos sobrevivirán hasta albergar el estadio infectante para subsecuentemente transmitir la infección. La inclusión de LM infectante en la ecuaciones (3)–(6) tiene un efecto muy pronunciado sobre la prevalencia de infección, particularmente en los vectores. Dejamos al lector la tarea de repetir el ejercicio anterior suponiendo que para P. falciparum el período extrínseco de incubación es de aproximadamente 12 días (Bruce-Chwatt 1985). La nueva ecuación para el número básico de reproducción de casos es,
Puede apreciarse que variaciones relativamente pequeñas en r (la probabilidad de sobrevivencia diaria del vector) se traducirán de una forma marcadamente no-lineal en variaciones de R0 y C (pues r está elevada a la potencia de n); variaciones en a(la tasa de picada por mosquito) también ejercerán un efecto no-lineal (pero menos pronunciado pues a está elevada al cuadrado), mientras variaciones en q (la densidad de mosquitos por persona) se refl ejarán tan sólo en forma lineal. La consecuencia lógica de la ecuación (9) es que la disminución de la sobrevivencia del mosquito hembra tendrá proporcionalmente la mayor consecuencia sobre la disminución de la capacidad del paludismo para invadir y establecerse en una población de hospedadores, y la aplicación de insecticidas residuales, que penetran la cutícula del insecto cuando éste se posa para descansar sobre las paredes de las casas luego de la ingurgitación de sangre, es una manera ideal de ejercer reducciones substanciales de r. Esta fue sin duda la lógica racional detrás de los programas de erradicación de la malaria basados en la aplicación de DDT (Garrett-Jones1964; Gabaldón 1969). La otra cara de la moneda de esta extrema sensibilidad de R0 y C a cambios en r, es que en la práctica resulta muy difícil estimar con precisión los valores absolutos de estos indicadores epidemiológicos en una localidad dada. Errores de muestreo y sesgos involucrados en la estimación de cada uno de los componentes de estas ecuaciones (véase Pull y Grab 1974), difi cultades en la estimación de r (usualmente a través de la proporción de hembras paras), variación estocástica, etc. hacen que el cálculo de R0 basado en variables entomológicas se utilice hoy en día más para obtener una comprensión cualitativa de los factores que determinan la transmisión de un agente infeccioso en una cierta localidad que para evaluar operacionalmente el impacto de programas de control (Garrett-Jones y Grab 1964). Existen otras aproximaciones que descansan menos en variables entomológicas para estimar R0 tales como las basadas en la proporción de individuos susceptibles en equilibrio endémico (R0 = 1/((1-x*)(1- y* ))), o en la edad promedio de infección humana, A, en una población cuya expectativa media de vida es LN ( R0 = 1 + LN/ A/ ). En realidad, A). estas aproximaciones requieren que la infección conduzca al desarrollo de inmunidad de por vida, y que las poblaciones humanas tengan cierta estructura de edades y curvas de sobrevivencia poco compatibles con las observadas en países no industrializados. Para poblaciones en crecimiento, LN puede substituirse por G, el tiempo generacional promedio, y R0= 1 + G/A . En el caso específi co de la malaria, Gupta et al. (1994) han propuesto que la población de Plasmodium que circula en un área dada comprende un conjunto de cepas inmunológicamente distintas, contra cada una de las cuales sí se desarrolla inmunidad duradera. Sin embargo, el individuo no será inmune contra la ‘malaria’ hasta no haber estado expuesto a todas y cada una de dichas cepas, lo cual puede requerir un cierto número de años y explicar por qué en zonas con malaria holoendémica, los adultos parecen haber desarrollado inmunidad mientras los casos de malaria severa se observan en los niños menores de 5 años. De acuerdo a esta hipótesis, si hay n cepas diferentes que conforman la población de plasmodios en cierta localidad e ignorando el vector, 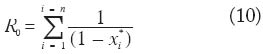
donde (1-xi*) es la proporción en equilibrio de individuos susceptibles a la cepa i. Finalmente, Dye (1994) ha sugerido que de emplearse la capacidad vectorial para el monitoreo de medidas de control, se utilice una medida relativa en lugar de la comparación de valores absolutos, como por ejemplo el cociente, s, entre C después de la intervención y Cantes de la misma,
donde ^ representa los valores estimados. Esto es así, pues de haber sesgos en dichas estimaciones, se supone que tales sesgos siempre actuarán en una dirección determinada y que el cociente permanecerá inalterado. Puede que no sea factible la cuantifi cación de todos los componentes de C, y puede que tampoco sea ésto C estrictamente necesario (Dye 1986). La selección de los elementos de la capacidad vectorial que se van a cuantifi car depende de a cuál o a cuáles parámetros es C más sensible dependiendo de la infección en cuestión y la medida de control implementada. Por ejemplo, en oncocercosis la tasa de picada anual (qa expresada en años) es un buen indicador del nivel de endemicidad (Dye y Baker 1986), si bien la magnitud de la tasa umbral de picada necesaria para alcanzar dicha endemicidad varía según la competencia vectorial de la especie local de simúlido principalmente involucrada en la transmisión (Basáñez et al. 2002). Si el programa de control se basa en medidas antivectoriales que reducen la tasa anual de picadas, puede bastar con medir el cambio relativo en este parámetro de C (por ejemplo, en el Programa de Control de la Oncocercosis, OCP, en África occidental). Si por el contrario, la población de vectores permanece intacta, y la población humana es tratada periódicamente con ivermectina (un fármaco microfilaricida), puede ser más conveniente evaluar el cambio relativo en la capacidad de los humanos de infectar a los simúlidos (un elemento de c). En malaria, y cuando no se ignora la latencia en el vector, C y R0 son particularmente sensibles al factor de longevidad arriba mencionado, y en caso de aplicación de insecticidas residuales que ejerzan un efecto adulticida sobre las hembras de los anofelinos, el cociente entre el factor de longevidad luego de la intervención y antes de la misma puede resultar un método apropiado de evaluación. Esperamos haber persuadido al lector de la contribución que la ecología de poblaciones puede aportar en el estudio de la epidemiología de enfermedades infecciosas, y de la utilidad que un enfoque cuantitativo puede tener a la hora de diseñar y monitorear estrategias racionales de control. Modelos de dinámica espacio-temporal en Malaria En esta sección se presentan resultados de una versión simplificada del modelo de Ross-Macdonald, que contempla la fragmentación espacial del ambiente. Una buena parte de los resultados discutidos en esta sección provienen de Torres-Sorando y Rodríguez (1997) y Rodríguez y Torres-Sorando (2001). Gran parte de la teoría ecológica existente hasta hace pocos años hizo la suposición de que las poblaciones naturales estaban distribuídas en ambientes espacialmente homogéneos. Sin embargo, se sabe que muchas de estas poblaciones están distribuídas en ambientes fragmentados. La consideración de este hecho ha dado origen a la moderna teoría de las metapoblaciones, que son poblaciones de subpoblaciones (Begon et al. 1996). No es de extrañar que la teoría cuantitativa moderna de la epidemiología, con una fuerte infl uencia de la teoría ecológica (Anderson 1991), haya sido enriquecida con el concepto de las metapoblaciones. De hecho así ha sido, y los modelos epidemiológicos que toman en cuenta la fragmentación espacial indican que ésta puede tener un efecto muy importante en la dinámica de las enfermedades infecciosas (Grenfell y Harwood 1997, Hess 1997, Th rall y Burdon 1997). Comenzaremos con una versión del modelo de Ross- Macdonald en la que se consideran números absolutos, no relativos, de individuos susceptibles e infectados. Esto se hace con el objeto de interpretar de una manera ecológica los resultados de ‘invadibilidad’. El modelo surge de multiplicar la ecuación (1) por N, y la ecuación (2) por M. De esta forma, si defi nimos X e Y como los números absolutos de humanos y mosquitos infectados, respectivamente, las ecuaciones se transforman en,
No existen evidencias empíricas concretas acerca de la forma de a como una función de N. Sin embargo es posible que en muchos casos esta forma sea la indicada por la Figura 2. Es decir, un mosquito incrementa el número de picadas sobre humanos por unidad de tiempo en forma lineal a densidades bajas de humanos. Pero a medida que la oferta de humanos es mayor el ritmo de aumento de la tasa de picada va decreciendo, y la misma se aproxima asintóticamente a un límite superior. Nótese que de los componentes de a (= h/g), el parámetro más sensible a la densidad de hospedadores es posiblemente h, la fracción de comidas sanguíneas de origen humano. Cuando la densidad de humanos es baja, h es probablemente baja pues es posible que la mayoría de las comidas sanguíneas provengan de hospedadores vertebrados alternativos; a medida que la densidad de humanos aumenta (y suponiendo que la población vectora es facultativamente antropofílica), h también aumentará pero obviamente no podrá ser mayor que 1, siendo 1/g el límite superior de a. Ahora bien, si suponemos que estamos en la parte inferior izquierda de la figura 2, a será proporcional a N, es decir podemos escribir a = aN , donde a, es una constante. Suponiendo adicionalmente, y por simplicidad, que p y c son iguales, y que por lo tanto ap = ac = b, resultan las ecuaciones siguientes, El par de ecuaciones (13) tienen implícita la suposición de que cuando un humano se expone a densidades crecientes de mosquitos, el número de picadas incrementa en forma proporcional. De los experimentos de Rubio-Palis et al. (1992) se pueden hacer unos cálculos que arrojan los gráfi cos mostrados en la Figura 3, y que corroboran la anterior suposición. En estos experimentos se expuso un humano durante una noche a las picadas de mosquitos, registrándose tanto el número de picadas como la densidad total de mosquitos. Como se observa en la Figura 3 hay una relación que se puede considerar lineal entre el número de picadas y la densidad del vector. Es posible, sin embargo, que experimentos como éste no registren de modo realista el comportamiento defensivo de los hospedadores, o la posible relación de dependencia entre el éxito de obtención de una comida sanguínea completa y la densidad total del vector. De ser éste el caso, el número reproductivo básico de la infección deja de ser una función lineal de la tasa de picada medida por qa (Kelly y Thomson 2000; Razali et al. 2002). Supondremos ahora que el sistema está distribuído en k subpoblaciones o localidades, entre las cuales puede haber visitación solamente de hospedadores humanos. Es decir, los mosquitos no se mueven entre localidades, solamente los humanos pueden visitar otras localidades. Supongamos también que el número total de humanos y mosquitos está equitativamente distribuido en las k subpoblaciones, es decir en cada localidad hay N/k humanos y M/k mosquitos. Llamaremos Xi e Yi al número de humanos y i mosquitos infectados, respectivamente, en la localidad i, con i=1,...,k. Supongamos también que una fracción hij del
tiempo que un humano
reside en su localidad ise dedica a visitar la localidad j Después de esas visitas, el humano regresa a su localidad de origen o residencia. Sea V={ hij }, con hij=1, es decir V es una matriz. Estamos entonces suponiendo que el humano tiene un tiempo de residencia constante, durante el cual permanece en su localidad de origen. Durante el resto de la unidad de tiempo hay visitaciones a otras localidades. Pero el tiempo total de visitación no es necesariamente constante. Es simplemente la suma de los tiempos de visitación, cada uno de los cuales puede depender de la distancia a la cual se encuentra la localidad visitada. Este escenario sería particularmente aplicable al caso de hospedadores humanos, que pueden planifi car sus actividades en el tiempo. De todo lo anterior podemos escribir,
Supondremos adicionalmente que pueden existir dos patrones de efecto de la distancia sobre el tiempo de visitación: a) Ausencia de efecto de la distancia sobre la visitación.
En este caso hij= h b) La fracción del tiempo de visitación decrece con la
distancia. Se supone que h es la probabilidad de
visitar una localidad que se encuentra a una unidad de distancia
por unidad de tiempo, y que hij
= heij, siendo eij el
número
de unidades de distancia entre
las localidades i y j Finalmente se supondrán dos arreglos espaciales posibles de las localidades en el espacio: un arreglo unidimensional y uno bidimensional. En la Figura 4 se muestra un ejemplo de ambos arreglos, en los que se muestra la dirección de la visitación de la segunda localidad al resto de las localidades. Se estudió el modelo descrito por las ecuaciones (14) en cada uno de los casos con análisis de invadibilidad. Este análisis proporciona la familia de parámetros del modelo que permite que la enfermedad se establezca en una población constituída únicamente por humanos y mosquitos susceptibles. Se basa en cálculos de autovalores de matrices jacobianas del sistema (14) evaluadas en equilibrios en los cuales la enfermedad está ausente (Rodríguez y Torres-Sorando 2001). Es posible demostrar que este criterio de permanencia de la enfermedad representa la otra cara de la moneda del método basado en el número reproductivo básico R0, anteriormente discutido. El Cuadro 4 y la Figura 5 muestran los resultados de este análisis. La figura 5 muestra unas fronteras de parámetros que fueron obtenidas con cálculos numéricos (círculos negros y segmentos), así como una aproximación analítica (líneas contínuas en el caso unidimensional con efecto de la distancia). Esta aproximación analítica surge del cálculo aproximado del autovalor dominante de la matriz de visitación V para el caso unidimensional con efecto de distancia, que es tanto más exacta cuanto mayor es el número de localidades, y que está basada en los resultados de Berlin y Kac (1952) y May (1974) (ver Rodríguez y Torres-Sorando 2001). De la observación de la Figura 5 se desprenden dos conclusiones fundamentales. En primer lugar la fragmentación espacial tiene siempre el efecto de disminuir las probabilidades de invasión de la enfermedad. Esto es evidentemente debido a que al fragmentar el espacio disminuye el contagio. Este efecto es más pronunciado cuando la visitación es menor, y cuando hay efecto de distancia. En segundo lugar, manteniendo otras cosas iguales, en un arreglo bidimensional es más fácil establecer la enfermedad que en un arreglo unidimensional. Quizá esto explique, en parte, por qué en regiones costeras de Venezuela hay menos malaria que en regiones tierra adentro (Yadira Rangel, comunicación personal). Para fi nalizar esta sección introduciremos una complicación adicional al modelo, con el fi n de hacerlo más realista. Ésta consiste en suponer que los humanos infectados poseen una movilidad inferior a la de los humanos susceptibles. Supongamos entonces que la visitación de un infectado es f veces la de un susceptible, con 0 < f < 1. Con esto las ecuaciones (14) se convierten en lo siguiente,
con i = 1,...,k. Utilizando la aproximación analítica para el caso unidimensional con efecto de distancia anteriormente referida, se puede llegar a demostrar que la enfermedad se establecerá cuando se cumpla la condición
En la figura 6 se muestra el resultado de la grafi cación de la condición (16). Como era de esperarse a mayor restricción de la movilidad de los infectados (menor valor de f) se f difi culta el establecimiento de la enfermedad. Estos resultados pueden ser útiles para fundamentar el diseño de programas de control en los cuales se implementan sistemas de diagnóstico y tratamiento oportunos e in situ, es decir, cuando los servicios regionales de salud pueden organizar sistemas locales para el tratamiento malárico sin requerir la movilización de los pacientes a otras áreas donde el vector también está presente. En áreas remotas como las del Alto Orinoco en la región amazónica, sin embargo, los enfermos pueden tender a transladarse desde sus aldeas hasta los dispensarios rurales en busca de tratamiento. También es posible que individuos asintomáticos pero parasitados, con mayor movilidad que aquellos en el medio de un episodio malárico agudo, continúen contribuyendo a la transmisión por tener gametocitos circulantes. Modelos de Intensidad. Oncocercosis La sección fi nal de este capítulo de modelos matemáticos en epidemiología de enfermedades transmitidas por vectores introduce en mayor detalle el uso de modelos de intensidad en macroparásitos y lo ejemplifi ca con un modelo sencillo de la dinámica poblacional de Onchocerca volvulus con particular referencia a su asociación con el vector simúlido. El modelo que discutiremos ha sido presentado por Basáñez y Boussinesq (1999) para á reas endémicas de África occidental y Camerún en particular, y por Basáñez y Ricárdez-Esquinca (2001) para Latinoamérica y específi camente México. Ya que estos autores presentan además una revisión actualizada de los diversos enfoques que se han utilizado hasta el presente para el modelaje de la dinámica de transmisión en oncocercosis, en este artículo nos concentraremos sobre modelos determinísticos. La oncocercosis es la infección causada por nemátodos fi larioideos de la familia Onchocercidae, de los cuales el género Onchocerca, y específi camente O. volvulus infecta al ser humano. Otras especies del género utilizan mamíferos ungulados como hospedadores defi nitivos. La oncocercosis humana, también conocida como ‘ceguera de los ríos’, ‘enfermedad de Robles’, ‘erisipela de la costa’ y ‘mal morado’, es transmitida por jejenes (‘moscas negras’) del género Simulium (Diptera: Simuliidae). Estas denominaciones de la enfermedad se refi eren principalmente a sus manifestaciones clínicas, las cuales pueden clasifi carse como oculares (incluyendo disminución de la agudeza visual y ceguera parcial o total) y cutáneas (incluyendo prurito o ‘sarna fi lariana’, cambios en la pigmentación de la piel, y disminución de su elasticidad). Los vectores simúlidos requieren de aguas corrientes para la oviposición y desarrollo de sus estadios inmaduros, de ahí que la distribución de la oncocercosis esté asociada a la distribución de ríos de aguas rápidas, ríos de montaña, rápidos y cascadas, con alto tenor de oxígeno y bajos niveles de polución. En este aspecto se diferencian de los vectores de malaria, más asociados con ecosistemas lénticos. Una exposición más detallada de la biología de los simúlidos puede encontrarse en Crosskey (1990). Se estima que aproximadamente 18 millones de personas están infectadas con O. volvulus a nivel mundial, la mayoría en África occidental (WHO 1995). En Latinoamérica la infección se encuentra en focos más circunscritos entre México y Guatemala, Colombia, Ecuador, norte de Venezuela, y en la región amazónica entre Venezuela y Brasil (Figura 7). El interés en el desarrollo de modelos matemáticos para la oncocercosis proviene del hecho de que los esfuerzos para controlarla han constituído uno de los programas más ambiciosos y costosos de control de vectores en la historia de la humanidad: el Programa para el Control de la Oncocercosis (OCP) en África occidental (Molyneux 1995). Este programa, iniciado en el año de 1975, se ha basado en la aplicación semanal y desde el aire de compuestos larvicidas en aquellos criaderos del vector localizados en zonas de sabana de primeramente siete y posteriormente once de los países afectados (los parásitos de sabana están asociados con una mayor incidencia de ceguera). Desde fi nales de la década de los 80, y en focos seleccionados, se ha introducido la distribución de ivermectina, un fármaco que destruye los estadios embrionarios del parásito (microfi larias), responsables de la patología asociada con la oncocercosis y transmitidos al vector. De este modo, la administración de ivermectina contribuye al mismo tiempo a la reducción de la morbilidad y de la transmisión. En otras regiones y países de África (regiones de selva, y países no pertenecientes a OCP), así como en Latinoamérica, los programas de control se basan exclusivamente en la distribución de ivermectina (Richards et al. 2001). Esta droga, bajo el nombre de Mectizan® está siendo donada por Merck & Co. por cuanto tiempo sea necesario para la eliminación de la oncocercosis. Ha sido, y continúa pues siendo de suma importancia conocer por cuánto tiempo deben mantenerse estos programas, la duración y frecuencia de su administración, el riesgo de recrudescencia luego de su interrupción, y la posible aparición y expansión de resistencia. Con la clausura de OCP a fi nales del 2002, y la inevitable repoblación de los criaderos del vector, la obtención de respuestas robustas y sólidamente fundamentadas a estas preguntas es aún más crucial. En la siguiente sección exploraremos cómo los modelos de dinámica de transmisión pueden jugar un papel fundamental en el conocimiento de la biología poblacional y la evaluación de estrategias de control de la oncocercosis humana. Ciclo de vida. A diferencia de la malaria, en la cual hay multiplicación del parásito en humanos y vectores, en la oncocercosis los vermes adultos (w), los cuales forman nódulos subcutáneos (oncocercomas) se reproducen sexualmente en el hospedador humano (N) pero no aumentan su número sino por inmigración y establecimiento de larvas infectantes, L3 (l) transmitidas l durante la picada de las moscas negras (M). Los parásitos M adultos son dioicos (sexos separados), así que es necesario que se encuentren y apareen en el hospedador defi nitivo. La probabilidad con la que esto ocurre se denomina probabilidad de apareamiento (f) y depende, entre otras cosas, de la densidad de parásitos y de la distribución de los mismos en la población de hospedadores. Cuando la distribución es agregada y los parásitos son polígamos, f tiende rápidamente a 1 cuando w tiende a 10 para valores típicos del parámetro k ( k << 1) de la distribución binomial negativa (Anderson y May 1985). Una proporción s de vermes pertenece al sexo femenino. Las hembras fecundadas producen microfi larias (m) a una tasa per capita l, la cual puede convertirse en una tasa de fecundidad per capita y miligramo de piel, F, dividiendo l entre p, el peso de la piel que recubre la totalidad de la superfi cie corporal. A diferencia de otras especies de fi larias, las microfi larias de O. volvulus se encuentran en piel y no en sangre periférica. La expectativa promedio de vida reproductiva de las hembras adultas es de 10 ± 3 años (Plaisier et al. 1991), por lo cual consideraremos que en ausencia de mortalidad dependiente de la edad, la tasa per capita de mortalidad de las hembras adultas es sw = 1/10 año-1. La tasa per capita de mortalidad de las microfi larias es sm = 0.8 año-1, ya que las mismas pueden sobrevivir en la piel por un promedio de 1-2 años (Duke 1993), a menos que sean ingeridas durante la comida sanguínea de los simúlidos vectores. Dada la larga expectativa de vida de los parásitos, no ignoraremos en este caso la tasa de mortalidad de los humanos, sino que consideraremos 1/(sw + µ ) y 1/(sm + µ ), con µ = 0.02 año-1 para una expectativa promedio de vida humana de 50 años en áreas endémicas. Al igual que en el modelo anterior, la tasa de picada por mosca sobre humanos es a y q es el cociente M/N. Durante la picada, los jejenes pueden cortar la piel con sus mandíbulas y maxilas y producir ruptura de los capilares superfi ciales, reclutando microfi larias hacia el hematoma. Una vez ingeridas, las microfi larias pueden ser laceradas por ciertas protuberancias quitinosas situadas en la base del cibario de algunas especies de simúlidos (la llamada armadura cibarial, Reid 1978, 1994) y deberán atravesar la matriz peritrófi ca que se forma alrededor de la comida sanguínea previamente a su digestión (Reid y Lehane 1984). Sólo aquellas microfi larias que logran migrar a través del epitelio abdominal, hacia el hemocele del vector, e instalarse en las fi bras musculares toráxicas del simúlido podrán proseguir su desarrollo hacia larvas L3 con probabilidad dM. Dicho desarrollo dura aproximadamente una semana bajo condiciones tropicales (2 a 3 ciclos gonadotrófi cos del vector), lo cual representa una proporción importante de la expectativa de vida de la mosca, por lo cual tomaremos en cuenta la sobrevivencia de las larvas infectantes y del simúlido, 1/(sl + v). Una vez desarrolladas, las larvas L3 migran hacia la cabeza y en particular la proboscis del simúlido desde donde iuna fracción w es transmitida al hospedero humano durante la picada. En el humano, el período de incubación intrínseca (desde el momento de infección hasta el momento en que pueden detectarse microfi larias en la piel) es de aproximadamente 1 año y la proporción de larvas infectantes que alcanza la madurez reproductiva es dN . La Figura 8 muestra el ciclo vital de N. O. volvulus, y la Figura 9 representa un diagrama de fl ujo de los principales procesos que determinan la dinámica poblacional del parásito. El Cuadro 5 contiene los valores de los parámetros utilizados en el modelo. Desarrollo del Modelo Ignorando por los momentos estructura explícita de edades, podemos escribir tres ecuaciones diferenciales que describen la tasa de cambio con respecto al tiempo del número promedio de vermes adultos por hospedador, w, del número de microfi larias por miligramo de piel, m, y del número de larvas infectantes por mosca, l,
Expresiones explícitas para dN , dM, y v como funciones de las intensidades de transmisión e infección serán presentadas en la sección dedicada a la evidencia en favor de la operación de mecanismos de regulación densodependiente en la oncocercosis. El modelo ha sido calibrado con los valores de los parámetros que se presentan en el Cuadro 5. Densodependencia. Mediante estudios de infección experimental de simúlidos se ha podido demostrar que si bien la ingesta de microfi larias es proporcional a la oferta de parásitos en la piel (Basáñez et al. 1994, 2000), la proporción que se desarrolla hasta larvas L3 en las moscas, dM, es una función decreciente del número de par M ásitos ingeridos (Basáñez et al. 1995, 2000). Sin embargo, tanto el comportamiento inicial de dicha función como la proporción neta de parásitos exitosos dependen, en parte, de que la especie vectora posea o no una armadura cibarial bien desarrollada (Figura 10). Esto parece deberse al hecho de que los ‘dientes’ del cibario lesionan una elevada fracción del total de microfi larias ingeridas, la cual no podrá completar su desarrollo. Dicha fracción no parece ser constante sino dependiente de la densidad de parásitos en la ingesta; a menor número de microfi larias mayor la fracción lesionada, la cual se estabiliza en un 40% para S. ochraceum y en un 60% para S. oyapockense(Basáñez et al. 1998). Asimismo, la magnitud de la tasa de mortalidad de vectores infectados, que depende del número de microfi larias ingeridas (Figura 11), varía según la especie de simúlido tenga o no una armadura cibarial bien desarrollada (Basáñez et al. 1996); para ingestas semejantes, las especies sin armadura sufren mayor mortalidad y mayor reducción de la expectativa de vida infectante que las especies ‘ protegidas’ por la posesión de un cibario armado. Esto se debe a que elevadas ingestas de microfi larias viables pueden causar la muerte de la mosca por invasión masiva de los órganos del insecto (Omar y Garms 1975, 1977). La importancia epidemiológica de este delicado balance entre sobrevivencia y competencia vectoriales sólo puede apreciarse en el contexto de modelos de dinámica de transmisión. A fi n de simplifi car la diversidad de vectores con fi nes de modelaje, clasifi caremos las principales especies según posean o carezcan de una armadura cibarial bien desarrollada (Cuadro 6). Los valores de los parámetros para dM, cM ,y z han sido presentados en Basáñez y Boussinesq (1999), y Basáñez y Ricárdez-Esquinca (2001). La inclusión única de mecanismos de regulación en el simúlido no es sufi ciente, sin embargo, para que los resultados del modelo puedan reproducir los valores observados del promedio de vermes por persona en poblaciones humanas, haciéndose necesario incorporar regulación en el hospedador defi nitivo. Basáñez et al. (2002), basados en Dietz (1982) proponen que el establecimiento de larvas infectantes en el humano, dN , es una función decreciente , de la intensidad de transmisión en la comunidad, medida por el potencial anual de transmisión: el número promedio de larvas L3 recibido por una persona expuesta a la picada de los simúlidos durante un año (Duke 1968). Esta función (Figura 12) puede describirse como,
donde L es el potencial anual de transmisión (y por consiguiente igual a q a l(t)), dNo y dN(x) son las fracciones de larvas L3 que alcanzan la madurez reproductiva cuando 0 ? tiende a cero y a infi nito, respectivamente, y cN una medida inversa del potencial anual de transmisión para el cual ocurre la transición entre dNo y dN(x) , con dNo >>dN(x). Podemos entonces re-escribir las ecuaciones (17) y (19) 0 0 de la manera siguiente tomando en cuenta regulación densodependiente en humanos y moscas,
donde j = 0 corresponde a las especies sin armadura cibarial (S. damnosum s.l., S. metallicum s.l., l S. exiguum s.l. y S. guianense s.l.) y j = 1 a las especies con cibario armado (S. ochraceum s.l., S. quadrivittatum, S. oyapockense s.l./S. roraimense y S. incrustatum/S. limbatum). Nótese que el modelo no incluye densodependencia en la producción o muerte de las microfi larias. Es posible que esta suposición tenga que ser modifi cada en vista de la evidencia, en pacientes con la forma localizada de oncocercosis conocida como ‘sowda’, y en O. ochengi, de mortalidad de microfi larias mediada por el sistema inmunológico (Trees et al. 1992; Horeauf y Brattig 2002). El número Reproductivo Básico (R0) en Macroparásitos En la sección dedicada a la malaria defi nimos R0 como el número promedio de casos generados durante la duración de un evento malárico en una población de hospedadores completamente susceptibles. Ya que en los modelos de macroparásitos la unidad de estudio es el número de parásitos (en lugar de solamente el número de casos), el umbral para la introducción y persistencia de la infección se defi ne como el número promedio de vermes hembra que ha alcanzado la madurez reproductiva producido en un ambiente dado por una hembra adulta durante su vida reproductiva en ausencia de mecanismos de regulación densodependiente (Anderson y May 1991). Esta defi nición, sin embargo, no es tan simple como parece, pues además de las complicaciones introducidas por la probabilidad de apareamiento en parásitos con sexos separados ya mencionada (f en sí misma es densodependiente), existe una diferencia sutil entre caracterizar el éxito de un parásito en invadir una población de hospedadores como el incremento en el número de parásitos, o como el requerimiento adicional de que la abundancia del parásito también aumente en términos del número de hospedadores infectados (Diekmann y Heesterbeek 2000). Algunos autores son de la opinión que R0 no está defi nido en aquellas condiciones para las cuales la densidad de parásitos tiende (en el límite) a cero (un requerimiento para la ausencia de densodependencia), sino que la condición R0 > 1 requiere de una cierta intensidad de infección ? 0 para la cual f > 0. Valores de infección por encima de este umbral tenderán al equilibrio endémico no trivial (w*, m*, l = 0); valores por debajo tenderán hacia el equilibrio trivial (w* = m* l > 0). Esta intensidad umbral de infección constituye pues un punto de equilibrio inestable del sistema y una meta deseable para programas de eliminación (Macdonald 1965). Sin embargo, para parásitos con distribución agregada, dicho equilibrio inestable puede estar muy cerca del equilibrio trivial como para tener verdadera importancia epidemiológica en la interrupción de la transmisión, es decir, es necesario reducir la población del parásito a niveles indistinguibles de su extinción para poder lograr su extinción! La siguiente expresión de R0 para O. volvulus ha sido derivada mediante análisis formal de estabilidad por Basáñez (1996) para localidades donde los simúlidos vectores carecen de una armadura cibarial bien desarrollada,
donde dN0 y dM0 son, respectivamente, las fracciones de parásitos que se establecen exitosamente en el humano 0 0 y la mosca cuando las intensidades de transmisión y de infección tienden a cero. En el caso de simúlidos con cibario armado, no se produce establecimiento de microfi larias en el vector cuando m ® 0 (una situación análoga a la impuesta por la necesidad de apareamiento) y por tanto defi nimos R0 como el máximo (Rmax) de la función que describe el número reproductivo efectivo, Re, en la cual dN es una función decreciente de la intensidad de transmisión (ecuación (20)), y dM y son funciones de la intensidad de infección por microfi larias (ver Cuadro 6). La Figura 13 compara el comportamiento del número reproductivo efectivo como una función de la intensidad de microfi larias en localidades donde los principales vectores carecen o poseen armadura cibarial, suponiendo f = 1 y variando la tasa anual de picada. Los valores de m para los cuales Re = 1 son los puntos de equilibrio del sistema. A medida que la tasa de picada de los vectores aumenta, disminuye la magnitud de la intensidad de infección correspondiente al equilibrio inestable que surge cuando los simúlidos poseen un cibario armado. Aplicaciones del Modelaje en la Evaluación de Programas de Control El modelo descrito en las ecuaciones (17)–(19) y (20)–(22) ha sido utilizado para investigar el efecto de programas de control de la oncocercosis basados en nodulectomía (extirpación de los nódulos subcutáneos que albergan las fi larias adultas) e ivermectina en México (Basáñez y Ricárdez-Esquinca 2001), donde el principal vector pertenece al complejo S. ochraceum s.l. Según los l resultados presentados en la Figura 14, la nodulectomía por sí sola (línea de puntos y rayas) no es sufi cientemente efectiva en reducir la población parasitaria. Esto se debe probablemente a que no todos los nódulos son palpables, no todos los nódulos palpables son extirpados, y cierta proporción de parásitos nunca forma nódulos subcutáneos o se encuentra en localizaciones accesibles (Duke 1993). La ivermectina por sí sola no ejerce un efecto signifi cativo sobre la viabilidad de las fi larias adultas, cuya población se recuperaría por inmigración y establecimiento de larvas L3 si se suspendiera la nodulectomía (línea de puntos). Más adelante, se logra disminuir paulatinamente la transmisión al reducirse periódica y sostenidamente la carga microfi lariana en piel. Además, se supuso que laivermectina reduce la fecundidad de los vermes adultos en un 30% con cada tratamiento anual (Plaisier et al. 1995). Los resultados observados por el programa de control de la oncocercosis en México (círculos) son reproducidos ú nicamente mediante la combinación de nodulectomía e ivermectina (línea contínua) con las coberturas registradas por el programa. Direcciones futuras. Los pocos modelos que consideran distribuciones de frecuencia de parásitos en forma explícita lo hacen suponiendo, en una forma por lo general empírica, que la distribución agregada del número de vermes por hospedador se ajusta a una binomial negativa, sin explorar en profundidad los mecanismos que pueden generar heterogeneidad entre hospedadores (variabilidad en la exposición, susceptibilidad, factores genéticos, respuesta inmunológica, etc.). Más recientemente, se ha utilizado una aproximación diferente para la construcción de modelos en macroparásitos basada en el uso de ecuaciones de clausura de momentos (Grenfell et al. 1995a). Haciendo ciertas suposiciones acerca de la distribución de los momentos de orden superior, estas ecuaciones permiten representar tanto el promedio del número de parásitos por hospedador como su varianza y covarianza en relación con las cargas parasitarias correspondientes a otros estadios y medidas fenomenológicas de inmunidad y mortalidad inducida por el parásito (Grenfell et al. 1995b). Los modelos anteriormente descritos tanto para malaria como para oncocercosis suponen que la distribución de los vectores sobre la población de hospedadores es homogénea. La incorporación de heterogeneidad en la preferencia del vector por alimentarse sobre varios hospedadores, dependiendo de la densidad y abundancia relativa de hospedadores y vectores, mejora la habilidad del modelo para reproducir la carga observada de larvas L3 por simúlido (Razali et al. 2002). De importancia para programas de lucha antivectorial, una relación de dependencia inversa entre la magnitud del parámetro h y la abundancia total de vectores M, resulta en que M R0 deja de ser una función lineal de la tasa de picada qa, de tal manera que para ejercer una reducción signifi cativa de R0 se requerirían reducciones drásticas de la abundancia vectorial. Esto sugiere que modelos futuros deberán explorar, en forma explícita, las posibles consecuencias de heterogeneidad en el contacto hospedador-vector (Dye y Hasibeder 1986; Woolhouse et al. 1997; Kelly y Th ompson 2000). Para finalizar, los programas de control de la oncocercosis recientemente implementados en Latinoamérica (OEPA: Programa de Eliminación de la Oncocercosis en las Américas), y en África (APOC: Programa Africano para Control de la Oncocercosis), se basan exclusivamente en la distribución de ivermectina una vez al año (APOC) o cada seis meses (OEPA), con la finalidad, respectivamente, de reducir la morbilidad asociada a la infección o de eliminar las poblaciones del parásito en aquellos focos donde la extinción local se considera posible (Richards et al. 2001). Sin embargo, resulta obvio que debido a: i) la larga duración de la expectativa de vida de la hembra adulta reproductivamente activa y de las microfilarias en piel; ii) el hecho que la ivermectina no elimina el parásito adulto; iii) la relativamente baja cobertura geográfi ca y terapéutica que puede obtenerse debido a dificultades logísticas y criterios actuales de exclusión; iv) el riesgo de reinfección presentado por la migración de personas o moscas infectadas, y v) los procesos de regulación densodependiente identificados y discutidos, los programas de distribución de ivermectina requerirán una duración prolongada y sostenible (de al menos 15 años), elevados niveles de adherencia al tratamiento, amplia distribución, y un diálogo permanente entre las actividades de control y la investigación en dinámica de transmisión. Destaca entonces en forma clara la necesidad de desarrollar modelos que incorporen la relación entre infección y morbilidad, y que incluyan elementos de genética de poblaciones a fin de investigar la posible evolución de resistencia a la ivermectina (Boussinesq y Gardon 1999). Por último, estos modelos deberán enlazarse con análisis de costo-efectividad y costo-benefi cio de los programas de control. Si bien la ivermectina puede obtenerse gratuitamente, los costos involucrados en entrenamiento, transporte, tratamiento, monitoreo de reacciones adversas, y evaluación del impacto del programa, entre otros, no son despreciables. Consideraciones tales como el costo por persona tratada, caso de infección severa prevenida, costo por comunidad fuertemente infectada vs. ligeramente infectada, etc. pueden ponerse en un contexto poblacional y comunitario solamente cuando se integran con modelos robustamente desarrollados y sufi cientemente validados de la epidemiología de la infección y enfermedad. Agradecimientos María-Gloria Basáñez agradece el apoyo del CONICIT (proyecto S1-1473), del Wellcome Trust (proyecto 047399), de la Embajada Británica (Cheevening Scholarship), del Consejo Británico (Programa de Enlace Académico), y del CAICET, en particular de los integrantes pasados y presentes de la Unidad de Investigación en Oncocercosis y Laboratorio de Simúlidos en este nuestro vigésimo aniversario de trabajo conjunto. Diego Rodríguez agradece el soporte del Consejo de Desarrollo Científi co y Humanístico de la Universidad Central de Venezuela (Proyecto PG 033143361999). REFERENCIAS
© 2004- Sociedad Venezolana de Entomología The following images related to this document are available:Photo images[em04020f11.jpg] [em04020f5.jpg] [em04020t6.jpg] [em04020f13.jpg] [em04020t2.jpg] [em04020t4.jpg] [em04020f7.jpg] [em04020f2.jpg] [em04020t5.jpg] [em04020f1.jpg] [em04020f12.jpg] [em04020f14.jpg] [em04020f3.jpg] [em04020f4.jpg] [em04020f10.jpg] [em04020f6.jpg] [em04020f8.jpg] [em04020t3.jpg] [em04020f9.jpg] [em04020t1.jpg] |
| |||||||||