Morillo F, Notz A. 2001.
Resistencia de Spodoptera frugiperda (Smith) (Lepidoptera: Noctuidae) a
lambdacihalotrina y metomil. Entomotropica Vol. 16(2):79-87.
Se evaluó la resistencia de
Spodoptera frugiperda (Smith) a los insecticidas lambdacihalotrina y
metomil (formulación de concentrado emulsionable), mediante la realización de
bioensayos de susceptibilidad y presión de selección en poblaciones de
laboratorio. También se evaluó la resistencia en las poblaciones de campo
Valle de Tucutunemo (VT) y Arenales _Tocorón (AT), ambas del Edo. Aragua. Se
utilizó el método de inmersión de larvas del tercer instar en 5,0 ml de
soluciones de cada insecticida, durante 30 segundos. Se emplearon cinco
concentraciones por cada insecticida, las cuales oscilaron entre 5,0-55,0 ppm
y 280,0-1600,0 ppm para lambdacihalotrina y metomil, respectivamente.
Adicionalmente, se evaluó la respuesta de un grupo de larvas (control) con
agua destilada solamente. La presión de selección se realizó durante siete
generaciones. La población seleccionada con lambdacihalotrina varió su razón
de resistencia (RR50) de 19,4 a 41,9 veces entre P0 y F9,
mientras que en la colonia seleccionada con metomil, la RR50 osciló
de 3,1 veces en P0 a 22,1 veces en F9. La RR50
para lambdacihalotrina en las colonias VT y AT fueron 62,0 y 65,7
respectivamente; para metomil se registró una RR50 de 10,6 y 3,8 en
las respectivas colonias. Los altos niveles de resistencia obtenidos
demuestran la necesidad de implementar estrategias de manejo de la resistencia
en S. frugiperda.
Palabras clave adicionales:
gusano cogollero del maíz, insecticidas, tolerancia.
ABSTRACT
Morillo F, Notz A. 2001.
Resistence of Spodoptera frugiperda (Smith) (Lepidoptera: Noctuidae) to
lambdacyhalothrin and methomyl. Entomotropica Vol. 16(2):79-87.
Resistance of Spodoptera
frugiperda (Smith) to insecticides lambdacyhalothrin and methomyl
(concentrated emulsifiable formulation) was evaluated in laboratory strains.
The resistance was also evaluated in the Valle de Tucutunemo (VT) and Arenales
_Tocorón (AT) field strains, both in Aragua State. The method consisted of
inmersion of a group of ten third instar larvae in 5.0 ml of solutions of each
product, during 30 seconds was used. Five concentrations were used of each
insecticide, which ranged from 5.0-55.0 ppm and 280.0-1600.0 ppm for
lambdacyhalothrin and methomyl, respectively, and larvae group as a control in
distillated water alone. Selection pressure was carried out during seven
generations. The resistance ratio (RR50) of the lambdacyhalothrin-selected
strain varied from 19.4 to 41.9-fold between P0 and F9,
whereas in methomyl-selected strain the RR50 ranged from 3.1-fold
in P0 to 22.1-fold in F9. The RR50 for
lambdacyhalothrin in the VT and AT field strains were 62.0 and 65.7
respectively; in methomyl the RR50 registered values of 10.6 and
3.8-fold in the respective strains. The high resistance levels obtained
demonstrates the necessity to implement strategies of resistance management in
S. frugiperda.
Additional key words: fall
armyworm, insecticides, tolerance.
INTRODUCTIÓN
La resistencia a insecticidas ha sido demostrada en varias
especies de insectos plaga. La ocurrencia de este fenómeno está ampliamente
expandida en las regiones agrícolas del mundo. Representa la respuesta a la
prolongada exposición a insecticidas que actúa como una fuerza de selección, la
cual concentra los distintos factores genéticos preexistentes en diferentes
organismos y que confieren resistencia (Plapp y Wang 1983). Para el año 1984 se
reportan 504 especies de insectos y ácaros resistentes a plaguicidas (Georghiou
1986). Esta cifra incluye insectos nocivos a la agricultura o que están
relacionados directa o indirectamente con el hombre, contra los cuales ha sido
dirigido el control químico.
Otro aspecto de gran importancia generado por la resistencia es
el costo, tanto para el productor agrícola como para las empresas fabricantes de
los plaguicidas. Generalmente, la primera reacción del agricultor cuando un
insecticida pierde su efectividad es incrementar la dosis y frecuencia de
aplicación, lo que trae como resultado el aumento del costo directo en el
control de plagas (McPheron 1995), a la vez que tienden a incrementarse los
niveles de resistencia. Por otro lado, el costo para la empresa de agroquímicos
en el desarrollo de un plaguicida fue estimado en 1,2 millones de dólares en
1956, 20 millones en 1981 y cerca de 60 millones en 1995 (Georghiou 1986;
McPheron 1995), además el tiempo de síntesis y desarrollo de una molécula, hasta
la comercialización de por lo menos un producto ocurre aproximadamente después
de 8 a 10 años. Estos aspectos demuestran la importancia de medidas de manejo de
la resistencia que alarguen la vida útil de los insecticidas y retrasen hasta
donde sea posible el desarrollo de resistencia.
En Sur, Centro y Norteamérica se han registrado varias especies
de insectos resistentes a diferentes grupos de insecticidas. En Venezuela,
Spodoptera frugiperda (Smith) (Lepidoptera: Noctuidae), Anthonomus
grandis (Boheman) (Coleoptera: Curculionidae) y Alabama
argillacea (Hübner) (Lepidoptera: Noctuidae) fueron reportados como
resistentes a DDT y ciclodienos (Georghiou y Mellon 1983), productos con escasa
comercialización actualmente en el país. Sin embargo, hasta la fecha, no se han
documentado casos de resistencia a insecticidas de los grupos órganofosforados,
carbamatos o piretroides, debido a la escasez de las investigaciones en el país.
En EE.UU., también en 1983, se señaló a S. frugiperda con
resistencia a insecticidas de todos los grupos químicos (DDT, ciclodienos,
órganofosforados, carbamatos y piretroides) (Georghiou y Mellon 1983). En México
se realizó un monitoreo sistémico de resistencia en el gusano cogollero del maíz
durante el período 1987-1990, estudio que señaló alta resistencia a insecticidas
órganofosforados (Pacheco-Covarrubias 1993). En 1991 aumentaron los casos
documentados de resistencia en poblaciones de S. frugiperda provenientes
de Gainesville, Florida (EE.UU.), poblaciones que mostraron niveles de
resistencia moderados, a insecticidas pertenecientes a los principales grupos
químicos (organofosforados, carbamatos y piretroides), como producto de la
enorme presión de selección a la que fue sometido el insecto en esa zona
productora de maíz (Yu 1991).
El presente trabajo tiene como objetivo evaluar la resistencia
de S. frugiperda, plaga de importancia económica en cultivos como maíz y
algodón, a los insecticidas lambdacihalotrina (piretroide) y metomil (carbamato),
empleando formulaciones comerciales sobre colonias de laboratorio sometidas a
presión de selección y colonias de campo del insecto bajo estudio.
MATERAIALES Y MÉTODOS
El estudio se realizó en el insectario del Instituto de Zoología
Agrícola de la Facultad de Agronomía de la Universidad Central de Venezuela, en
condiciones ambientales, con promedios de temperatura y humedad relativa de
25,18 ± 5,96 °C y 75 ± 10 % respectivamente, y un fotoperíodo de 12 horas luz.
Los insecticidas empleados fueron el piretroide lambdacihalotrina
[ciano-3-fenoxibencil-3-(2-cloro-3,3,3-trifluoro-1-propanil)-2,2-dimetil-ciclopropano
carboxilato] 5 % C E (KARATE ®), y el carbamato metomil [S-metil-N-(metilcarbamoiloxi)-tiocetimidato]
25 % C E (LANNATE L ®). Para los bioensayos se utilizaron larvas del tercer
instar de S. frugiperda, obtenidas mediante el establecimiento de una
población de laboratorio, con larvas colectadas en campos de maíz del
asentamiento campesino La Cuarta, Municipio Libertador, Edo. Aragua. Las larvas
fueron alimentadas y mantenidas según la metodología de García (1982), los
adultos fueron alimentados con una solución azucarada al 25 %. Una vez
multiplicada y estabilizada la colonia, se separaron tres grupos; el primero fue
sometido a presión de selección con lambdacihalotrina (colonia EIL), el segundo
fue tratado con el insecticida metomil (colonia EIM) y el tercero constituyó la
colonia control no expuesta a insecticidas (NEI). Todos los bioensayos se
realizaron desde enero de 1997 hasta abril de 1998.
Estimación de las concentraciones letales CL50 de
lambdacihalotrina y metomil en S. frugiperda
Los bioensayos para la estimación de las concentraciones CL50
se realizaron con el método de inmersión de larvas del tercer instar en cada una
de las cinco dosis previamente seleccionadas para cada compuesto químico,
durante un tiempo de 30 segundos (Watkinson et al. 1984; ICI 1986; Herrero
1987). Las dosis fueron seleccionadas mediante la realización de ensayos
preliminares para determinar la ventana de respuesta biológica del insecto,
usando en la fase inicial, un amplio rango de concentraciones (0,01; 0,1; 1; 10;
100; 1000, 10.000 ppm) que causaron mortalidades entre 0 y 100%, luego se redujo
el rango hasta la selección final de dosis intermedias (Robertson et al. 1984;
Saume 1992; Lagunes y Villanueva 1994). Las dosis fueron preparadas a partir de
una solución madre de 1000 ppm para lambdacihalotrina y 5000 ppm para metomil, a
razón de 5,0; 8,0; 18,0; 43,0; 55,0 ppm y 280,0; 345,0; 665,0; 1300,0; 1600,0
ppm, respectivamente. En la inmersión se utilizaron grupos de 10 larvas
con un peso promedio de 24,7 ± 5,3 mg. Se realizaron 10 repeticiones por cada
dosis. Como tratamiento testigo se trataron larvas de la misma edad en agua
destilada, bajo el criterio de que las formulaciones comerciales aplicadas en el
campo son diluidas en agua. Transcurrido el tiempo de inmersión, los individuos
fueron colocados sobre papel absorbente. Posteriormente, éstos se mantuvieron
individualizados en envases cerrados de 12 cc, sin alimento, en condiciones de
laboratorio entre 24 y 28 ºC y fotoperíodo de 12 horas luz. Se efectuó la
evaluación a las 24 horas después de la inmersión, donde se cuantificó el número
de larvas vivas y muertas en cada tratamiento. Los resultados de mortalidad se
sometieron al análisis de varianza mediante el Probit Analysis Program (Raymond
1985), para determinar las concentraciones letales estimadas CL50 y
CL95.
Pruebas de presión de selección y resistencia sobre larvas de
S. frugiperda
En la fase inicial de la selección, se expuso un mínimo de 1000
larvas del tercer instar de S. frugiperda para lambdacihalotrina (colonia
EIL) y 925 larvas del mismo insecto para metomil (colonia EIM) usando la CL50
estimada para cada producto. Los individuos sobrevivientes a las 24 horas,
fueron colectados y alimentados hasta su completo desarrollo, estos insectos
constituyeron la generación parental (P0). La progenie de estos
individuos o F1 fue expuesta a la CL60, posteriormente las
progenies sucesivas fueron seleccionadas a concentraciones consecutivas de CL70
(F2), CL80 (F3), CL90 (F4).
Las generaciones F6 y F8, fueron sometidas a presión de
selección con sus respectivas CL90, para finalizar el proceso
selectivo. Los datos obtenidos se sometieron al análisis Probit (Raymond 1985) y
se compararon a través de la pendiente (b) de la curva
concentración-mortalidad y los intervalos de confianza (IC) al 95 % de
probabilidad. Por otro lado, se realizaron comparaciones con la CL50
y la pendiente de la cepa NEI, bajo el criterio de cotejar cambios de tolerancia
del insecto a través del tiempo desde un mismo punto de partida, con una colonia
que no fue sometida a presión de selección.
La resistencia de S. frugiperda a lambdacihalotrina y
metomil se determinó mediante comparación (razón) de las
CL50 de las colonias EIL y EIM en cada generación, con la
concentración CL50 respectiva de una "colonia susceptible" (colonia
GV) proporcionada por el Departamento de Agricultura de EE.UU. (USDA) con sede
en Gainesville, Florida. Esta colonia susceptible ha permanecido por más de doce
(12) años sin ningún tipo de exposición a insecticidas, criterio por el cual se
evaluó como patrón para resistencia. La tasa de desarrollo de resistencia (r)
en las generaciones sometidas a presión de selección para cada insecticida, se
calculó mediante la fórmula utilizada por Pap y Tóth (1995), modificada:
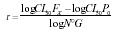
donde:
CL50FX es la concentración letal media de la
generación seleccionada, CL50P0 es la concentración letal
media de la generación parental y N° G el número de generaciones.
Adicionalmente, se evaluó la resistencia cruzada en las colonias
sometidas a presión de selección con los productos químicos antes señalados.
Esto se realizó utilizando la metodología empleada para la estimación de la CL50,
descrita anteriormente. Se determinó la CL50 para metomil en la
colonia tratada con lambdacihalotrina (EIL) y la CL50 para
lambdacihalotrina en la colonia EIM tratada con metomil, ambas en la última
generación evaluada. También se evaluó la resistencia en colonias de campo de
S. frugiperda, colectadas en febrero de 1998, en las localidades
Valle de Tucutunemo (VT), zona que produce maíz para semilla y consumo fresco
durante todo el año, y Arenales-Tocorón (AT), localidad con una producción de
maíz de un ciclo por año; ambas regiones pertenecen al Estado Aragua. Unas 235
larvas por localidad, fueron extraídas del cogollo de plantas de maíz de 1,25 m
de altura (50 a 60 días después de la siembra) y colocadas en bolsas de papel
(con promedio de 10-15 larvas por bolsa) con trozos de follaje y transportadas,
en cajas de cartón debidamente cerradas e identificadas, al laboratorio donde se
realizaron las pruebas correspondientes.
RESULTADOS Y DISCUSIÓN
Los resultados de la respuesta de colonias de S. frugiperda
sometidas a presión de selección con lambdacihalotrina (colonia EIL) se muestran
en el Cuadro 1. La CL50 de la colonia EIL
oscila entre 17,5 y 37,7 ppm en las generaciones seleccionadas; la pendiente de
la curva varió de 1,31 en la generación parental a 1,26 en la F9.
Estos resultados indican cierto incremento de la tolerancia de S.
frugiperda a lambdacihalotrina y una respuesta heterogénea, cuando el
insecto es sometido a presión de selección. Por otro lado, en la cepa no
sometida a selección (NEI) la CL50 tomó un valor de 5,1 en la F9,
y los intervalos de confianza no se solapan, lo que indica que las pendientes
son significativamente diferentes.
Con relación a la resistencia, al comparar la RR50
en cada generación seleccionada (Cuadro
1), apreciamos
como se incrementa de 19,4 veces a 41,9 veces en relación con la colonia GV, a
excepción de la F3 en la que se observa una pequeña disminución.
Adicionalmente, la tasa de desarrollo de resistencia (r) desde la
generación parental a la F9 es igual 0,35 y de F6 a F9
es 0,12; cifras que señalan un estancamiento en el desarrollo de la resistencia
a lambdacihalotrina en las generaciones evaluadas, a pesar de los ligeros
incrementos de las CL50 en las mismas generaciones.
En lo referente a las colonias de campo, se observa en la
Figura1-A, que las poblaciones VT y AT, están bastante
desplazadas a la derecha de la colonia susceptible (GV), con una respuesta
relativa (RR50) de 62,0 y 65,7 veces, respectivamente; estas colonias
de campo también presentan una pendiente ligeramente inferior a la colonia GV y
los intervalos de confianza de la CL50, no se solapan, aspecto que
indica que la b entre las colonias de campo y GV son significativamente
diferentes, lo cual sugiere que las poblaciones de campo presentan altos niveles
de resistencia a dicho piretroide, según las categorías de Shen et al. (1993).
La respuesta de la colonia sometida a presión de selección con
metomil (EIM), se muestra en el
Cuadro 2. Se puede
observar que la CL50 varió de 396,2 a 2752,5 ppm, aspecto que sugiere
incrementos en la tolerancia a metomil. Por otra parte, los valores de la
pendiente en las generaciones seleccionadas disminuyeron a medida que avanzó la
presión, inclusive son menores en comparación con la población GV; esta
tendencia a la disminución se debe a que van sobreviviendo más individuos
tolerantes al insecticida, lo que produce una respuesta genéticamente
heterogénea de la colonia EIM debido al agente seleccionador (metomil); en otras
especies de insectos se han señalado pendientes con tendencia similar a la
reportada en el presente trabajo (Brewer et al. 1990, Bush et al. 1993, McKenzie
y Byford 1993).
En relación con la resistencia de S. frugiperda a metomil
(Cuadro 2) se apreció que la RR50 pasó de 3,1
veces en P0 a 22,1 veces en F9, cifras que demostraron un
incremento de la resistencia al nivel de la CL50. Al evaluar la tasa
de desarrollo de resistencia se aprecia que la r, entre las generaciones
F1 y F6, adquirió un valor de 0,29 y que entre F6
y F9 fue de 1,29; estas cifras sugieren la existencia de dos fases
bien definidas: la primera fase entre F1-F6 o fase de
estancamiento de r y la segunda fase entre F6-F9 o
fase de lento desarrollo de resistencia a metomil. Probablemente esta última
fase se extiende algunas generaciones más allá a la F9.
Adicionalmente la tasa total de desarrollo de resistencia en el período evaluado
(F1-F9) fue de 0,88 para metomil.
Las colonias de campo presentaron niveles de resistencia a
metomil de 3,8 veces en la colonia AT, y 10,6 veces en la colonia VT (Cuadro
2). Adicionalmente, las curvas concentración-mortalidad de AT, VT y EIM, se
encuentran a la derecha de la curva GV (Figura
1-B), por
otro lado, la pendiente de la curva en la colonia AT es mayor en comparación a
las generaciones seleccionadas y la colonia GV con diferencias significativas;
este resultado sugiere una respuesta más homogénea de la colonia de campo AT a
metomil.
En cuanto a la resistencia cruzada, cuando se evalúa la
susceptibilidad de la colonia EIM a lambdacihalotrina (Cuadro
1) observamos que la RR50 tiene un valor de 19,1 veces en
relación con la colonia GV, valor similar a la condición inicial del experimento
(P0), (Figura 2-A), mientras que la
susceptibilidad de la colonia EIL a metomil genera una razón de resistencia 13,3
veces más alta que la colonia susceptible (Cuadro
2),
valor mayor al observado en la respuesta de la generación parental (Figura
2-B) a metomil. Estos resultados sugieren que los mecanismos de resistencia
a piretroides y carbamatos pudieran estar siendo estimulados en ambas
situaciones de presión de selección. Cabe resaltar que la importancia del
metabolismo oxidativo (OFM) en la resistencia a carbamatos, fue verificada en
una colonia de Musca domestica L. (Diptera: Muscidae) resistente a
Metomil (Price y Chapman 1987), desde entonces ha sido reconocido como el
principal mecanismo de resistencia a carbamatos en insectos (Saume 1992,
McPheron 1995). Por otro lado, se atribuye la resistencia a piretroides en mosca
doméstica a tres mecanismos principales: insensibilidad del sitio de acción,
incremento del metabolismo oxidativo y disminución de la penetración (Scott y
Georghiou 1985, Mac Donald et al. 1985). Sin embargo, se ha observado que el
tipo de piretroide (estructura química) no tiene efecto sobre el grado de
resistencia cuando el metabolismo oxidativo es el principal mecanismo (Scott y
Georghiou 1986).
En investigaciones realizadas por Pacheco-Covarrubias (1993) en
S. frugiperda se registraron niveles de resistencia a permetrina que
oscilaron entre 1,74 y 4,10 veces, también se señaló una alta resistencia a
insecticidas órganofosforados. En otro trabajo (Yu 1991) se determinó que la
resistencia de S. frugiperda a piretroides (permetrina, cipermetrina,
cihalotrina, fenvalerato, fluvalinato y otros) en colonias de campo se encontró
en el rango de 2,0 a 216 veces, mientras que el valor específico para
cihalotrina fue de 12,5 veces, valor que es inferior al obtenido en este trabajo
para lambdacihalotrina (del mismo grupo químico) en las colonias de campo, en
esa misma investigación se reporta una resistencia a metomil de 14,4 veces,
cifra ligeramente superior a lo obtenido en la colonia VT que fue de 10,6.
En poblaciones de Spodoptera exigua (Hübner)
(Lepidoptera: Noctuidae) sometidas a presión de selección con el piretroide
fenvalerato (grado técnico), Brewer et al. (1990) demostraron un incremento de
RR50 de 8,3 veces, en relación con la colonia susceptible, en la
generación número 20. Los mayores aumentos de resistencia ocurrieron en las
primeras seis generaciones; adicionalmente, la pendiente de la curva en cada
relación concentración-mortalidad tendió a disminuir, resultado que concuerda al
obtenido en la presente investigación aún cuando se trata de especies distintas.
Por otra parte, Glenn et al. (1994), al trabajar con
Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae) provenientes de campo
de cultivos de maíz dulce, encontraron una RR50 a fenvalerato de 14 a
34 veces más alta en comparación a una colonia susceptible. En otro estudio,
larvas de Platynota idaeusalis (Walker) (Lepidoptera: Tortricidae) recién
emergidas fueron expuestas a dosis subletales de azinfosmetil durante varias
generaciones, el rango de la RR50 fue de 11 a 16 veces mayor que la
colonia no tratada (Bush et al. 1993), además la pendiente de la curva
concentración mortalidad tendió a disminuir a medida del avance del experimento.
En poblaciones de Haematobia irritans (L.) (Diptera: Muscidae)
seleccionadas con permetrina, ivermectina y diazinón durante varias generaciones
en condiciones de laboratorio, se reportó incremento de la resistencia en las
generaciones 21, 30 y 31 para cada insecticida, respectivamente (McKenzie y
Byford 1993). En las primeras 17 generaciones la tasa de desarrollo de
resistencia, se mantuvo estable y la pendiente de la curva
concentración-mortalidad tendió a disminuir.
Una colonia de M. domestica, expuesta a presión de
selección durante 5 generaciones con cipermetrina resultó 503 y 236 veces más
resistente en comparación con la colonia susceptible a nivel de DL50
y DL95, respectivamente (Learmount 1994). A diferencia de lo que
ocurre en las referencias ya citadas, la pendiente es más alta en las primeras
generaciones seleccionadas. Esto sugirió un aumento de la homogeneidad en la
respuesta de la mosca doméstica a la cipermetrina. Scott y Georghiou (1985)
también reportan altas fluctuaciones de la pendiente de la curva en generaciones
de la mosca doméstica seleccionadas con permetrina. Otra investigación realizada
en M. doméstica sometida a selección con betacipermetrina durante 25
generaciones consecutivas (Pap y Tóth 1995) reportó una RR50 de 164,9
y 190,2 veces mayor a la colonia susceptible en la última generación evaluada,
para hembras y machos, respectivamente; las primeras tres generaciones de
selección representaron una fase estable de la tasa de desarrollo de resistencia,
mientras que las cuatro siguientes generaciones de selección señalaron un rápido
incremento de r. En el presente trabajo, el desarrollo de resistencia de
S. frugiperda a lambdacihalotrina permaneció estancado después de 7
generaciones de presión, mientras que para metomil la fase estancada se mantuvo
durante 6 generaciones, también se señalaron valores de pendiente que fluctuaron
a lo largo de la selección. Sin embargo, en las primeras generaciones la
pendiente tendió a disminuir.
Las diferencias en las tasas de desarrollo de resistencia entre
los diferentes trabajos mencionados y lo obtenido en la presente investigación
indican que r varía entre las especies de insectos (inter e
intraespecíficamente), las clases de insecticidas y, obviamente, el tiempo de
exposición a los compuestos químicos. Sin embargo, demuestran la existencia de
gran potencial de desarrollo de resistencia innato en cada especie cuando son
sometidas a presión de selección (en el laboratorio o en el campo), aún cuando
se empleen formulaciones comerciales de los productos utilizados.
Según Shen et al. (1993), la resistencia a lambdacihalotrina en
las colonias de campo, evaluadas en el presente trabajo, se pueden considerar de
"altos niveles de resistencia", mientras que para metomil se pueden considerar
de "tolerancia a bajos niveles de resistencia". Esto podría constituir la base
para transferir información a productores, empresas de agroquímicos y
organizaciones gubernamentales relacionadas con el problema y alertar las áreas
agrícolas estudiadas y aquellas regiones donde el uso de plaguicidas es excesivo
para el control de insectos (áreas algodoneras, zonas hortícolas y áreas
maiceras como el caso del Valle de Tucutunemo) de tal manera que, mediante un
uso racional y ordenado, se eviten problemas colaterales a causa del desarrollo
de resistencia. Es importante destacar, que la realización de monitoreos de
resistencia a insecticidas, en S. frugiperda y otros insectos plaga, debe
cumplir con varias fases, que van desde la evaluación del efecto del insecticida
en el laboratorio, determinación de los mecanismos de destoxificación de
insecticidas y evaluación de fórmulas comerciales. Esto permitirá establecer con
criterios, que insecto es resistente o susceptible, y determinar las medidas a
usar en su manejo.
AGRADECIMIENTOS
Los autores desean expresar su más sincero agradecimiento a
Frederick Adams, del Departamento de Agricultura de los Estados Unidos
(Gainesville, Florida), quien cordialmente suministró la colonia susceptible a
insecticidas, del insecto objeto de la investigación. A Nilda Yaneth Pérez,
Franklin Rojas, Oscar Rivero, Ricardina Colmenares, Darjaniva Molina y Larry,
por su gran colaboración en el desarrollo de este trabajo. A FUNDACITE-Aragua,
por el apoyo financiero a través del proyecto DLAG-0044 y a Zéneca de Venezuela,
S. A., por el suministro de algunos productos químicos empleados en los
bioensayos.
REFERENCIAS
- Brewer MJ, Trumble JT, Alvarado-Rodríguez B, Chaney E. 1990.
Beet armyworm (Lepidoptera: Noctuidae) adult and larval susceptibility to
three insecticides in managed habitats and relationship to laboratory
selection for resistance. J Econ Entomol 83: 2136-2146.
- Bush MR, Abdel-Aal YA, Saito K, Rock GC. 1993.
Azinphosmethyl resistance in the tufted apple bud moth (Lepidoptera:
Tortricidae): reversion, diagnostic concentrations, associated esterases,
and glutathione transferases. J Econ Entomol 86(2):213-225.
- García JL. 1982. Estudio sobre la biología, comportamiento y
ecología de Spodoptera frugiperda (Smith) (Lepidoptera: Noctuidae).
[Tesis de Doctorado]. Maracay: Universidad Central de Venezuela. Fac Agronomía.
222 p.
- Georghiou GP.1986. The magnitude of the resistance problem.
In: National Academy of Sciences eds. Pesticide resistance: Strategies and
tactics for management. Washington, D. C. p. 14-43.
- Georghiou GP, Mellon RB.1983. Pesticide resistance in time
and space. In: Georghiou G P, and Saito T, eds. Pest resistance to
pesticides. New York: Plenum Press. p 175-205.
- Glenn DC, Hoffman AA, Mc Donald G. 1994. Resistance to
Pyretroids in Helicoverpa armigera (Lepidoptera: Noctuidae) from
corn: adult resistance, larval resistance, and fitness effects. J Econ
Entomol 87(5): 1165-1171.
- Herrero JL. 1987. Respuestas de Spodoptera frugiperda (Smith) (Lepidoptera:
Noctuidae) sometido a presión de selección con el
insecticida metomyl en generaciones sucesivas, utilizando el método de
inmersión. [Tesis de Grado]. Maracay: Universidad Central de Venezuela, Fac
Agronomía. 43 p.
- ICI Agrochemicals. 1986. Pyretroid resistance monitoring
kit. 12 p.
- Lagunes TA, Villanueva JA. 1994. Toxicología y manejo de
insecticidas. Colegio de Postgraduados- Entomología. Montecillo, Texcoco
Edo. de México. 264 p.
- Learmount J. 1994. Selection of houseflies (Diptera:
Muscidae) with a pyrethroid space Spray using a large-scale laboratory
method. J Econ Entomol 87(4):894-898.
- MacDonald RS, Surgeoner GA, Solomon KR, Harris CR. 1985.
Laboratory studies on the mechanisms of resistance to permethrin in a fied-selected
strain of house flies. Pestic Sci 16:10-16.
- McKenzie CL, Byford R L. 1993. Continuos, alternating and
mixed insecticides affect development of resistance in the horn fly (Diptera:
Muscidae). J Econ Entomol 86(4):1040-1048.
- McPheron B. 1995. Management of insecticide resistance.
Pennsylvania State University. Mimeografiado. 42 p.
- Pacheco-Covarrubias JJ. 1993. Monitoring insecticide
resistance in Spodoptera frugiperda populations from the Yaqui
Valley, Son., México. Resistant Pest Management Newsletter 5(1):3-4.
- Pap L, Tóth A. 1995. Development and characteristics of
resistance in the susceptible WHO/SRS house fly (Musca domestica)
strain sujected to selection with beta-cypermethrin. Pestic Sci 45:335-349.
- Plapp FW, Wang TC. 1983. Genetic origins of insecticide
resistance. In: Georghiou G P, and Saito T, eds. Pest resistance to
pesticides. New York: Plenum Press. p 47-70.
- Price RP, Chapman PA. 1987. Resistance to methomyl in a
laboratory selected and a field strain of the house fly, Musca domestica
(L.). Pestic Sci 20:167-177.
- Raymond M. 1985. Prèsentation d'un programme d'analyse log-probit
pour micro-ordinnateur. Cah. Ortoms, Sèr Ent Med et Parasitol 22(2):117-121.
- Saume F. 1992. Introducción a la Química y Toxicología de
Insecticidas. Primera edición. Maracay. 212 p.
- Scott JG, Georghiou GP. 1985. Rapid develoment of high-level
permethrin resistance in a field-collected strain of the house fly (Diptera:
Muscidae) under laboratory selection. J Econ Entomol 78:316_319.
- Scott JG, Georghiou GP. 1986. Mechanisms responsible for
high levels of permethrin resistance in the house fly. Pestic Sci
17:195-206.
- Shen J, Wu Y, Tan J, Zhou B, Chen J, Tan F. 1993. Comparison
of two monitoring methods for pyrethroid resistance in cotton bollworm
(Lepidoptera: Noctuidae). Resistant Pest Management Newsletter 5(1):5-7.
- Watkinson C, Wiseman A, Robinson T. 1984. A simple test kit
for field evaluation of the susceptibility of insect pests to insecticides.
British crop protection conference-pests and diseases. 6 A-20:559-564.
- Yu SJ. 1991. Insecticide resistance in the fall armyworm,
Spodoptera frugiperda (J. E. Smith). Pestic Biochem Physiol 39:84-91.
© 2001- Sociedad Venezolana de Entomología
The following images related to this document are available:
Photo images
[em01011t2.jpg]
[em01011t1.jpg]
[em01011f1.jpg]
[em01011f2.jpg]
